Blog
RPM 與 RCF 的差異:如何選擇最適合您實驗需求的離心機和離心管?
October 28,2024
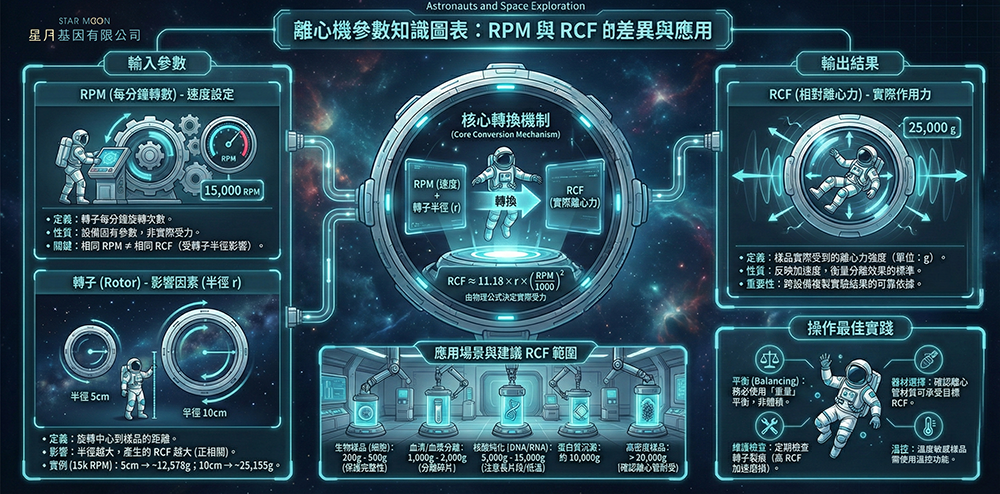
離心機在實驗室中的角色
離心機在現代實驗室中是核心設備之一,被廣泛應用於生命科學、化學、物理、臨床醫學等領域。其主要功能是通過旋轉分離樣品中的成分,如沉澱固體、血清、細胞培養和蛋白質樣本等。
離心機利用離心力將不同密度的物質分離開來,這一過程基於重力和向心力的相互作用,使得分離過程更加迅速和高效。
RCF 和 RPM 的定義與區別
離心機使用過程中,RPM(每分鐘轉數)和 RCF(相對離心力)是至關重要的兩個參數,但它們的作用和意義不同。為了讓使用者更好地理解,以下提供詳細的解釋:RPM(每分鐘轉數)
RPM 表示轉子的每分鐘旋轉次數。簡單來說,RPM 用來描述離心機運行的速度。
RPM 是一個設備固有的參數,當設定好 RPM 後,機器在運行中會以該速度旋轉。
然而,RPM 並不直接代表樣品受到的實際離心力,因為離心力的大小還受到轉子的半徑影響。
因此不同離心機、不同大小的轉子,設定相同的RPM,不一定會對樣品產生相同的離心力。
RPM 是一個設備固有的參數,當設定好 RPM 後,機器在運行中會以該速度旋轉。
然而,RPM 並不直接代表樣品受到的實際離心力,因為離心力的大小還受到轉子的半徑影響。
因此不同離心機、不同大小的轉子,設定相同的RPM,不一定會對樣品產生相同的離心力。
RCF(相對離心力)
RCF 是衡量離心過程中樣品受到的離心力強度。
這個單位用 g 倍數表示,反映樣品受到的加速度,是衡量離心過程中實際作用於樣品的力的標準。
RCF 提供了一個相對可靠的標準,在不同設備或轉子條件下,能讓使用者達成一致的分離效果。
因此,RCF 是在實驗溝通、重複與改善時更重要的資訊。
這個單位用 g 倍數表示,反映樣品受到的加速度,是衡量離心過程中實際作用於樣品的力的標準。
RCF 提供了一個相對可靠的標準,在不同設備或轉子條件下,能讓使用者達成一致的分離效果。
因此,RCF 是在實驗溝通、重複與改善時更重要的資訊。
這兩者之間的關係可通過以下公式進行轉換:
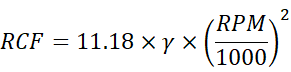
其中
因此,了解並計算 RCF 是至關重要的,尤其是相同實驗在不同轉子或設備之間進行分離操作並須要達到一致性的結果時。
為何在不同轉子直徑下相同 RPM 產生不同的 RCF?
當離心機設定固定的 RPM 時,不同轉子的半徑會導致樣品承受不同的 RCF。轉子的半徑越大,樣品距離旋轉中心越遠,其所承受的離心力也隨之增大。
因此,雖然離心機的轉速(RPM)相同,實際樣品承受的 RCF 卻可能大不相同。
這一現象解釋了為何在相同的 RPM 下,不同轉子會導致分離結果的差異。理解並正確應用這一點,有助於實驗設計者進行有效的實驗條件設置,從而保證分離效果的一致性。
舉例來說,在實驗中,如果需要保持 1000 g 的 RCF,但轉子半徑不同(例如 5 cm 和 10 cm),則所需的 RPM 將有所不同:
★ 半徑為 5 cm 的轉子:
使用上述公式可得
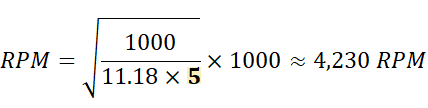
★ 半徑為 10 cm 的轉子
為了達到相同的 RCF,計算得出
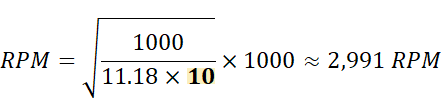
由此可見,當轉子半徑增大時,所需的 RPM 會下降。
而這表示,若是為了進行核酸純化、沉澱的離心作業,在 A 離心機以 10 cm 半徑的轉子,設定 15,000 RPM 時,可以順利沉澱核酸;換到 B 離心機的 5 cm 半徑的轉子一樣設定 15,000 RPM 時,則可能無法順利沉澱核酸。
因為 10 cm 半徑的轉子以 15,000 RPM 轉速旋轉時,產生的對樣品離心力約為 25,155 g;
但當換成 5 cm 半徑的轉子,並同樣設定 15,000 RPM 轉速旋轉時,產生的對樣品離心力則僅有約 12,578 g
因此,在進行實驗時,應更聚焦關注於 RCF 而非 RPM,才能讓您的實驗更輕鬆高效。
如何選擇合適的 RPM 和 RCF?
在設計和選擇離心條件時,應根據樣品的特性和實驗需求選擇合適的 RCF 和 RPM。以下是一些建議,以幫助離心機使用者達到最佳效果:1. 依據樣品性質設置 RCF
不同樣品對離心力的耐受性有所不同。
例如,生物樣品如細胞和蛋白質對較高的 RCF 較為敏感,因此需設置較低的 RCF,避免破壞樣品結構。
相反,沉澱金屬離子或分離高密度顆粒時,則可設置較高的 RCF。
例如,生物樣品如細胞和蛋白質對較高的 RCF 較為敏感,因此需設置較低的 RCF,避免破壞樣品結構。
相反,沉澱金屬離子或分離高密度顆粒時,則可設置較高的 RCF。
2. 選擇適合的轉子
離心機的轉子設計會影響樣品分離效果。
使用小半徑轉子可減少離心管的應力,但需要更高的 RPM 以達到相同的 RCF。
選擇適合樣品的轉子有助於增強實驗的穩定性和再現性。
使用小半徑轉子可減少離心管的應力,但需要更高的 RPM 以達到相同的 RCF。
選擇適合樣品的轉子有助於增強實驗的穩定性和再現性。
3. 確保實驗重現性
在需要多次離心分離的實驗中,建議使用相同的 RCF,而非 RPM。
這是因為 RCF 更能真實反映樣品所受的實際作用力,能保證不同設備或轉子間結果的一致性。
這是因為 RCF 更能真實反映樣品所受的實際作用力,能保證不同設備或轉子間結果的一致性。
4. 避免樣品過度分離或損壞
過高的 RCF 可能導致樣品過度分離或損壞。
因此,對於對應力敏感的樣品,應選擇相對較低的 RCF 進行離心,並適時檢查樣品狀態。
因此,對於對應力敏感的樣品,應選擇相對較低的 RCF 進行離心,並適時檢查樣品狀態。
常見的 RCF 應用選擇與操作建議
在不同設備或轉子條件下,離心操作可能需要經常進行 RCF 和 RPM 之間的轉換。以下是一些應用場景的建議:★ 生物樣品(如細胞)分離
通常建議使用 200 g 到 500 g 的 RCF,尤其適合敏感細胞,如初代細胞或培養細胞。
這一範圍能在保護細胞完整性的同時有效去除培養基中的懸浮雜質。
若更換不同轉子,可根據轉子的半徑重新計算 RPM,以確保離心效果一致。
這一範圍能在保護細胞完整性的同時有效去除培養基中的懸浮雜質。
若更換不同轉子,可根據轉子的半徑重新計算 RPM,以確保離心效果一致。
參考文獻:見於《Current Protocols in Cell Biology》中的細胞分離章節,以及 Beckman Coulter 和 Eppendorf 離心機應用指南。
★ 血清或血漿分離
建議使用約 1000 g 到 2000 g 的 RCF 來分離血清或血漿,此範圍有效分離血清或血漿中的細胞碎片而不會損害樣品。
參考文獻:如 Thermo Fisher Scientific 的離心機應用指南、Beckman Coulter 的臨床樣品處理手冊及文獻中的標準實驗操作指南。
★ 蛋白質沉澱
蛋白質沉澱通常需要更高的 RCF,一般在 10,000 g 左右,此範圍能有效促進蛋白質沉澱,適合於常見的蛋白質分離和純化操作。
參考文獻:如《Molecular Cloning: A Laboratory Manual》,Thermo Fisher 的蛋白質沉澱試劑套組操作指南,及其他生物化學技術參考文獻。
★ 核酸純化
核酸離心通常建議使用 5,000 g 到 15,000 g 的 RCF。
這一範圍內的離心力有助於有效分離 DNA、RNA 等核酸分子,尤其是在去除蛋白質、殘渣和其他雜質時能取得更好的效果。
核酸樣品對機械應力較為敏感,尤其是長片段 DNA 或質粒 DNA。
因此,設定較慢的加速和減速過程,有助於避免核酸損傷,保護樣品完整性。選用可溫控的離心機於低溫進行,可保護易降解的核酸分子(如:RNA)。
這一範圍內的離心力有助於有效分離 DNA、RNA 等核酸分子,尤其是在去除蛋白質、殘渣和其他雜質時能取得更好的效果。
核酸樣品對機械應力較為敏感,尤其是長片段 DNA 或質粒 DNA。
因此,設定較慢的加速和減速過程,有助於避免核酸損傷,保護樣品完整性。選用可溫控的離心機於低溫進行,可保護易降解的核酸分子(如:RNA)。
參考文獻:如 Qiagen 的核酸萃取試劑套組操作手冊、《Current Protocols in Molecular Biology》,以及《Molecular Cloning: A Laboratory Manual》等。
★ 高密度樣品(如金屬離子沉澱)
這類樣品對離心力需求較高,可使用更高的 RCF,通常在 20,000 g 甚至更高,因為高密度顆粒沉澱需要強力離心力。
但需注意離心管是否能承受這樣的離心力。
但需注意離心管是否能承受這樣的離心力。
參考文獻:見於 Hettich、Thermo Fisher 等設備製造商的高密度樣品沉澱應用指南,以及一些分離化學應用文獻。
離心機使用者的注意事項
1. 定期維護與校準
離心機的性能和安全性依賴於正確的維護。定期檢查轉子、離心管和密封件的狀況,尤其是長時間使用高 RPM 和 RCF 的情況下,確保設備的穩定性。(星月基因團隊有多年協助校準經驗,如有需求,歡迎與我們聯絡。)
2. 正確設置平衡
將樣品平衡放置在離心管內是每次離心操作的必要步驟。平衡不良可能導致轉子損壞,甚至影響離心機的安全性。
3. 不要使用三角平衡法來平衡樣品
三角平衡法在物理學上給予了相同的力矩,因此不會產生旋轉上的失衡;但對於機械設備而言,更在意的是穿過軸心的連線上是否有平衡物來穩定轉子,因此三角平衡法可正常操作離心機,長期卻有可能使離心機壽命下降。
4. 使用重量(秤重)而非體積來進行平衡
有時在離心時,奇數樣品可以輕鬆透過添加一管空管,並加入等量液體進行平衡。
但在進行細胞/微生物離心時、有 純化用 Column 時、或是溶液是多重複配而不是純水 (如培養基、血清、PBS等緩衝液)時,單純添加等量液體可能無法良好平衡,此時建議應先秤重需設置平衡位置對向(軸心連線)樣品的總重,並配置含管總重相等的平衡管,如此才能達到理想的平衡狀態。
但在進行細胞/微生物離心時、有 純化用 Column 時、或是溶液是多重複配而不是純水 (如培養基、血清、PBS等緩衝液)時,單純添加等量液體可能無法良好平衡,此時建議應先秤重需設置平衡位置對向(軸心連線)樣品的總重,並配置含管總重相等的平衡管,如此才能達到理想的平衡狀態。
5. 適當的冷卻或加熱控制
某些離心機配有溫度控制功能,對於易受溫度影響的生物樣品,適當的溫度控制有助於保護樣品穩定性。(星月基因提供各種規格的離心機。)
6. 選擇正確的離心管材質
根據樣品性質,選擇合適材質的離心管,以免樣品在高 RCF 下因應力過大而導致破裂。
(星月基因提供的 微量離心管 均可離心達 20,000 g,5mL 甚至可承受至 25,000 g。15mL 離心管可承受 16,000 g;50mL 離心管可承受 12,000 g,均符合一般生命科學實驗使用需求。)
(星月基因提供的 微量離心管 均可離心達 20,000 g,5mL 甚至可承受至 25,000 g。15mL 離心管可承受 16,000 g;50mL 離心管可承受 12,000 g,均符合一般生命科學實驗使用需求。)
 |
 |
 |
 |
7. 理解轉子壽命
高 RCF 的操作會加速轉子的磨損,甚至可能引發裂痕。
因此,應遵循製造商建議的使用壽命,並定期進行轉子檢查。
因此,應遵循製造商建議的使用壽命,並定期進行轉子檢查。
充分了解 RPM 和 RCF 的關係並正確應用,才能讓實驗操作更順利。
訂閱服務確認
您好,已發送 Email 驗證信給你,請點擊信件連結以完成訂閱程序
訂閱失敗
暫時無法接受訂閱,請稍候重新嘗試
